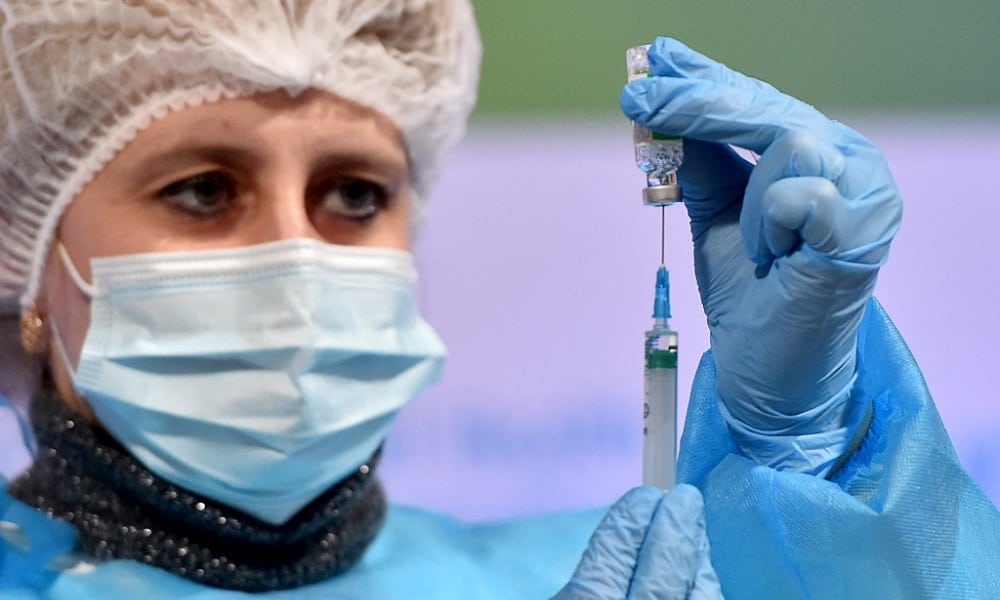
Una junta de seguridad que supervisa el ensayo de la vacuna COVID-19 de AstraZeneca está generando preocupaciones sobre los datos de la compañía.
En una declaración inusual posterior a la medianoche de este martes, el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID, por sus siglas en inglés) dijo que a la Junta de Monitoreo de Datos y Seguridad, que le preocupa que se haya incluido “información desactualizada” en los resultados del ensayo
El DSMB expresó su preocupación de que AstraZeneca pudiera haber incluido información desactualizada de ese ensayo, que puede haber proporcionado una vista incompleta de los datos de eficacia
dijo el NIAID en un comunicado
Además, invitaron a AstraZeneca a trabajar con el DSMB para revisar los datos de eficacia y garantizar que los datos de eficacia más precisos y actualizados se hagan públicos lo antes posible.
El DSMB, un grupo independiente dentro de la agencia responsable de revisar los estudios clínicos, también notificó a otras agencias federales de salud y a AstraZeneca directamente sobre sus preocupaciones.
Más tarde, AstraZeneca emitió un comunicado diciendo que su análisis intermedio se basó en datos con un corte del 17 de febrero y que había “revisado la evaluación preliminar del análisis primario y los resultados eran consistentes con el análisis intermedio”.
La compañía dijo que esperaba publicar los resultados de su análisis principal en 48 horas.
Las acciones de AstraZeneca cayeron hasta 5.5% y a las 8:56 am (horario de Ciudad de México) recortan sus pérdidas a 3.60%, para venderse en 49.35 dólares.
La compañía farmacéutica acababa de publicar los resultados preliminares de su prueba de vacuna COVID-19 en etapa tardía el lunes.
Esos resultados mostraron que dos dosis de la vacuna administradas con cuatro semanas de diferencia tenían una eficacia del 79% para prevenir los síntomas de COVID-19 y una eficacia del 100% para prevenir enfermedades graves y hospitalizaciones.
La Administración de Alimentos y Medicamentos se basará en los datos extraídos del estudio para decidir si concede a la vacuna AstraZeneca una autorización de uso de emergencia. La autorización permitiría el uso de la vacuna por parte del público en general para combatir la pandemia de coronavirus.
La vacuna ya se está utilizando en todo el mundo para prevenir COVID-19, pero su implementación inicial no ha sido nada fácil.
Varios países europeos suspendieron temporalmente el uso de la vacuna luego de informes de coagulación sanguínea en al menos 30 pacientes.
La mayoría de los países reanudaron su uso, pero después de que la Agencia Europea de Medicamentos realizar una investigación y declarar que la vacuna AstraZeneca es segura y eficaz.