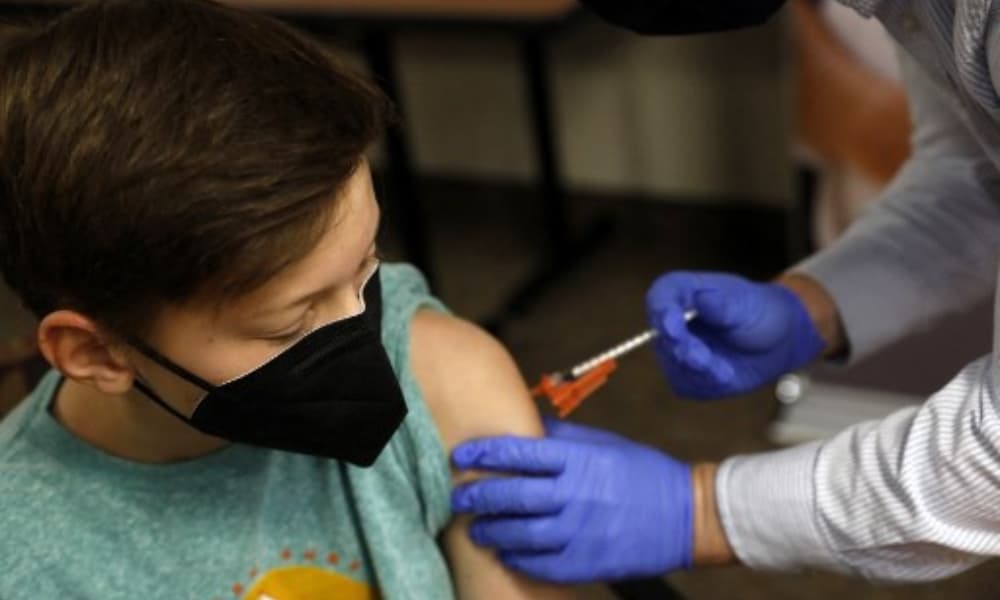
Este martes se reunirá un panel médico de expertos formado por asesores del gobierno de Estados Unidos para decidir si autoriza la vacuna contra el COVID-19 de Pfizer para niños de entre cinco y once años.
Si los expertos independientes convocados por la Administración de Alimentos y Medicamentos (FDA, por su sigla en inglés) votan a favor, como es de esperar, la autorización de emergencia estará lista en unas semanas. De este modo, los 28 millones de niños de esta franja etaria comenzarán a vacunarse en noviembre.
El grupo debe decidir con base a las pruebas científicas disponibles si los beneficios de la vacuna de dos dosis, administradas con tres semanas de diferencia, superan los riesgos conocidos.
Antes de la reunión, la FDA compartió un estudio de Pfizer que mostraba que la vacuna tenía una eficacia de 90.7% para prevenir el COVID-19 sintomático, con dosis de 10 microgramos en lugar de los 30 inoculados a los grupos de más edad, además de que no presentaba problemas de seguridad graves.
La farmacéutica estadounidense Moderna también anunció resultados positivos de su vacuna contra el COVID-19 en niños de entre 6 y 11 años, y tiene previsto presentar “a corto plazo” los datos a los organismos reguladores de todo el mundo para su aprobación.
La FDA también publicó su propio documento informativo con un análisis de riesgos y beneficios. Los científicos del organismo indicaron que los beneficios superan el eventual peor efecto secundario para este grupo de edad: la miocarditis, o inflamación del corazón.
“Mi opinión inicial es que los beneficios de vacunar a los niños de cinco a once años superan los riesgos de miocarditis y otras preocupaciones de seguridad que la gente pueda tener”, dijo a la AFP Henry Bernstein, pediatra del Centro Médico Infantil Cohen de Nueva York.
En total, 160 niños de entre 5 y 11 años murieron de COVID-19 en Estados Unidos, según datos oficiales.
También se produjeron más de 5,000 casos de síndrome inflamatorio multisistémico en niños (MIS-C), una complicación post viral rara, pero muy grave, que cobró 46 vidas.
“Por supuesto, (queremos) proteger a los niños, pero también queremos que no transmitan el virus del SARS-CoV-2 a los miembros de su familia y a otras personas de la comunidad”, dijo Bernstein.
Probabilidad de miocarditis baja
Pfizer evaluó los datos de seguridad entre 3,000 voluntarios, los efectos secundarios más comunes de la vacuna fueron leves o moderados, como dolor en el lugar de la inyección, fatiga, dolor de cabeza, dolor muscular y escalofríos.
No hubo casos de miocarditis o pericarditis (inflamación alrededor del corazón). Sin embargo, la empresa matizó que no había suficientes voluntarios para poder detectar efectos secundarios muy raros.
Solo se detectaron casos muy raros de miocarditis en adolescentes después de que se autorizó la vacuna en junio y se administró a millones de personas de esa franja etaria.
La FDA reconoció que, hipotéticamente hablando, si la transmisión de COVID-19 cae drásticamente, el número de casos de miocarditis provocados por la vacuna será mayor al de hospitalizaciones por COVID-19 evitadas.
Aun así, añadió, los beneficios seguirán superando los riesgos, ya que los casos de COVID-19 que no requieren hospitalización pueden tener consecuencias más graves a largo plazo que los efectos secundarios de la vacuna, que normalmente son temporales.
Estados Unidos está saliendo de su última ola, generada por la variante delta, sin embargo, la pandemia sigue propagándose rápidamente en los estados del norte, como Alaska, Montana, Wyoming e Idaho, con climas más fríos y con tasas de vacunación bajas.
En Estados Unidos, el 57% de la población está totalmente vacunada.
La confianza en las vacunas ha aumentado en los últimos meses, pero Estados Unidos sigue estando por detrás de los demás países del G7 en cuanto a porcentaje de población vacunada.